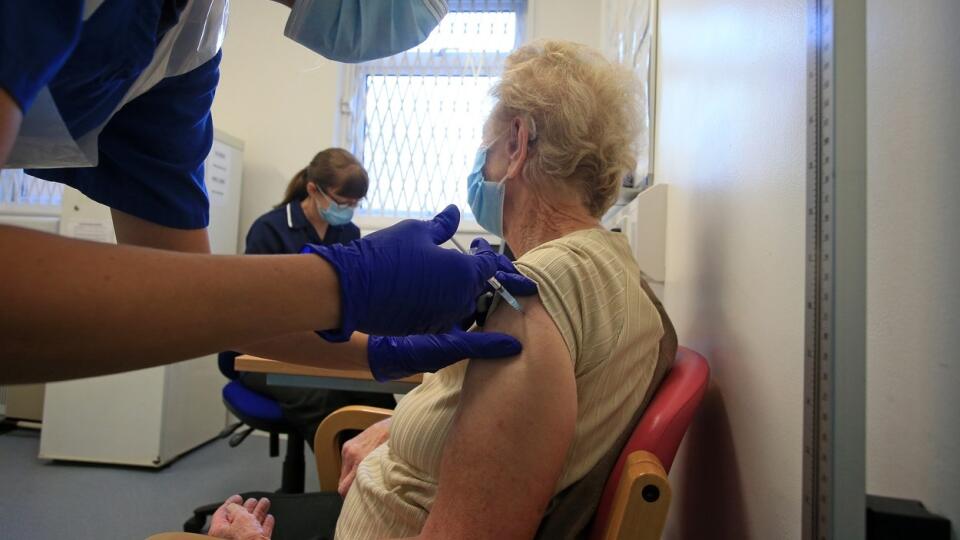
Európska agentúra pre lieky (EMA) v piatok odporučila, aby lekári z jednej ampulky vakcíny proti chorobe Covid-19 od spoločností Pfizer a BioNTech extrahovali šesť dávok namiesto doterajších piatich. Oznámila to samotná EMA na svojej webovej stránke.
Výbor EMA pre lieky na humánne použitie (CHMP) v piatok odporučil aktualizovať informácie o produkte s názvom Comirnaty, čiže vakcíny od konzorcia Pfizer/ BioNTech, aby bolo zrejmé, že každá ampulka obsahuje šesť možných dávok vakcíny namiesto piatich ako bolo pôvodne odporúčané.
Európska komisia nakúpi ďalších 300 miliónov dávok vakcíny Pfizer/BioNTech
Informáciu agentúry EMA potvrdil aj slovenský Štátny ústav pre kontrolu liečiv (ŠÚKL), ktorý spresnil, že na extrakciu šiestich dávok vakcíny je pri všetkých dávkach potrebné používať striekačky a ihly s tzv. malým mŕtvym priestorom.
EMA vo svojej tlačovej správe špecifikovala, že kombinácia striekačky s malým mŕtvym priestorom a ihly musí mať mŕtvy priestor najviac 35 mikrolitrov. Ak by sa použili štandardné injekčné striekačky a ihly, nemuselo by byť dostatočné množstvo vakcíny na extrahovanie šiestej dávky z jednej injekčnej ampulky.
Agentúra upozornila, že ak množstvo vakcíny zostávajúce v injekčnej liekovke po použití piatej dávky nemôže poskytnúť celú dávku (0,3 ml), zdravotnícky pracovník musí injekčnú liekovku a jej obsah zlikvidovať. Z viacerých injekčných liekoviek (so zostatkovým materiálom) by sa nemala zliať a vytvoriť celá nová dávka. Všetky nepoužité vakcíny sa musia zlikvidovať do šiestich hodín po zriedení.

V prvom týždni nahlásili viac ako 18 600 vzoriek pozitívnych na Covid-19
Je nevyhnutné, aby každý očkovaný človek dostal stanovenú dávku, v tomto prípade 0,3 ml. EMA opätovne pripomenula, že Comirnaty je vakcína na prevenciu koronavírusového ochorenia 2019 (Covid-19) u ľudí vo veku nad 16 rokov. V EÚ bola povolená 21. decembra 2020.
O zmenu v registrácii - v počte dávok v jednej liekovke - požiadal držiteľ rozhodnutia o registrácii. K prehodnoteniu počtu dávok môže dôjsť aj po registrácii vakcíny, ak držiteľ registrácie podáva žiadosť na orgán, ktorý registráciu schvaľoval; v tomto prípade to bola Európska komisia na základe hodnotenia Európskej liekovej agentúry.